Synthese- Holz- und Kohlegas
Inhaltsverzeichnis
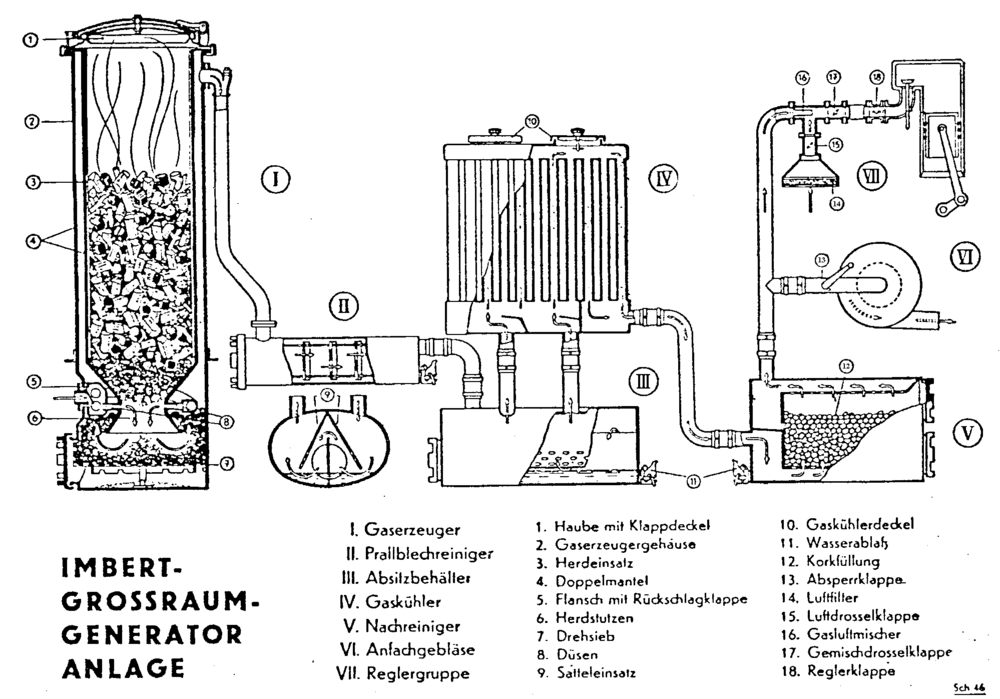
Imbert Holzvergaseranlage
Synthesegas
Was war zuerst da: Der Benzinmotor oder der Kraftstoff Benzin? Es ist die gleiche Frage wie die Henne oder das Ein. Der 4 Takt - Ottomotor wurde für das Leuchtgas besser bekannt Stadtgas entwickelt und sollte die ineffektiven und teurer Dampfmaschinen ersetzen. Leucht- bzw Stadtgas wurde für die Beleuchtung von Straßen und Häuser für Gasherde und Durchlauferhitzer genutzt.
Zusammensetzung des Leuchtgases:
- ca. Wasserstoff H2 (51 %)
- ca. Methan CH4 (21 %)
- ca. Stickstoff N2 (15 %)
- ca. Kohlenstoffmonoxid CO (9 %)
Grundsätzlich können alle Kohlenstoffquellen genutzt werden um Synthesegas herzustellen. Pflanzen oder Kunststoffe nur die erzeugte Hitze innerhalb des Synthesegas Erzeugers muss ausreichend hoch sein um langkettige Kohlenwasserstoffverbindungen zu spalten, Wasserstoff und Kohlenstoffmonoxid zu erzeugen.
Siehe: https://de.wikipedia.org/wiki/Stadtgas
Siehe: https://de.wikipedia.org/wiki/Kohlevergasung
Wassergas
Über die endotherme Reaktion:
- C + H2O ⟶ CO + H ΔHR=+131 kJ/mol
- 2C + 2H2O ⟶ 2CO + H2 ΔHR=+262 kJ/mol
entsteht aus Kohle, die zuvor durch Verbrennung an Luft aufgeheizt wurde, und Wasserdampf sogenanntes Wassergas, eine Mischung aus Kohlenstoffmonoxid und Wasserstoff. Es handelt sich um eine Gleichgewichtsreaktion.
Diese Reaktion wurde 1780 von Felice Fontana entdeckt.
Das entstehende Gas wird unter anderem auch als Synthesegas oder Syngas bezeichnet, da es sich für die Synthese verschiedener chemischer Substanzen wie Methanol eignet.
Generatorgas (Kohlenstoffmonoxid)
Generatorgas wird durch unvollständige Verbrennung von Koks mit Luft erzeugt. Hierbei reagiert Kohle, die zuvor durch Verbrennung an Luft aufgeheizt wurde, mit Kohlendioxid in einer Gleichgewichtsreaktion (Boudouard-Gleichgewicht) zu Kohlenstoffmonoxid.
- C + O2 ⟶ CO2
- C + CO2 ⟶ 2 CO
Die Gesamtreaktion ergibt sich zu:
- 2 C + O2 ⟶ 2 CO
Kohlehydrierung
Bei der Kohlehydrierung entstehen Kohlenwasserstoffe unterschiedlicher Kettenlängen:
- m C + n H ⟶ CmHn
Je nach Kettenlänge sind die Reaktionsprodukte gasförmig (Methan, Ethan, Propan, Butan) oder flüssig (höhere Alkane, die beispielsweise Verwendung finden in Benzin und Dieselkraftstoff).
Bei flüssigen Produkten spricht man von Kohleverflüssigung.
Konvertierungen
Hierbei werden Gase in Sekundärreaktionen aus den Produkten der Kohlevergasung erzeugt.
Konvertierung zu Wasserstoff:
- <math>\mathrm{CO\ +\ H_2O\ \longrightarrow\ CO_2 \ +\ H_2}\qquad \Delta H_R = -42,3\ \mathrm{kJ/mol}\,</math>
Konvertierung zu Methan:
- <math>\mathrm{CO\ + 3\ H_2\ \longrightarrow\ CH_4\ +\ H_2O}\qquad \Delta H_R = -206\ \mathrm{kJ/mol}\,</math>
IMBERT "Synthesegasreaktor"
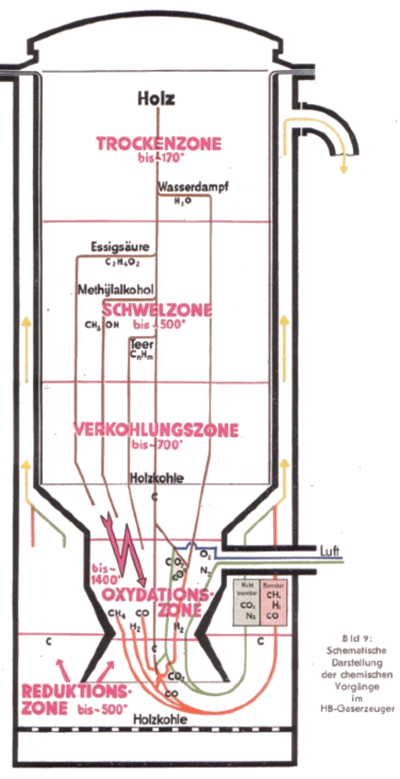
Die Holzkohle wird bei bis ca. 1400° oxidiert, es entsteht CO und CO2. Die dabei entstehende Wärme hält den Prozess in Gang. Das Wasser wird zu Sauerstoff und Wasserstoff zerlegt, ausserdem wird Holzessig umgewandelt zu Methan (CH4). Der Holzteer schliesslich (lange C+H+O Moleküle) wird in flüchtigere Bestandteile gecrackt. Die notwendige Temperatur darf keinesfalls unterschritten werden. Der Herd zwischen Oxidations- und Reduktionszone ist konisch, sodass sich in allen Lastzuständen eine Hochtemperaturzone bildet. Ein Teil der Holzkohle fällt unverbrannt durch den Herd und bildet die sogenannte Reduktionszone.
Glühende Holzkohle ist hochreaktiv. Bei ca. 500°C reduziert sich das verbliebene Kohlendioxid (CO2) zu brennbarem Kohlenmonoxid (CO). Wasserdampf (H2O) spaltet sich zu Wasserstoff (H2) und Sauerstoff (O). Der Sauerstoff verbindet sich mit der glühenden Kohle und bildet Kohlenmonoxid (CO). Teerbestandteile (bestehend aus langen C+H+O Molekülen) werden in mehreren Schritten zu CO und H2 umgewandelt. |
"Synthesegasreaktor Skizze" | |
Das entstandene Gasgemisch nennt sich Holzgas, es ist ein Schwachgas. Nach der Gaserzeugung wird der mitgeführte Schmutz gefiltert und das heiße Gas gekühlt, um die Dichte und damit die Leistung zu erhöhen. Eine Reduktionszone kann nur mit Hartholz gebildet werden. Das heißt, nur Holz das Holzkohle bildet, ist als Brennstoff geeignet. Bei zu hohem Anteil von Weichholz, bei zu viel Rinde und Sägemehl, sowie bei feinem Material (kleine Hackschnitzel) kann sich keine gute Reduktionszone bilden. Die Gasqualität ist schlecht und der Teer wird nicht gespalten, er kondensiert im Motor und verklebt dadurch Ventile und Kolben.
In der Sprache des Chemikers lässt sich der Vorgang folgendermaßen ausdrücken:
Oxidation
- C + O2 = CO2 (Wärme erzeugend)
Wasserstoffbildung
- CO + H2O = CO2 + H2 (leicht Wärme erzeugend)
- C + H2O = CO + H2 (Wärme verbrauchend)
Reduktion
- CO2 + C = CO + CO (Wärme verbrauchend)
Die Zusammensetzung des Gases ist durchschnittlich wie folgt:
- Kohlenmonoxid CO 23%
- Wasserstoff H2 18%
- Methan CH4 2-4%
- Kohlendioxid CO2 10%
- Stickstoff N2 47%
Der untere Heizwert beträgt 1200 - 1400 kcal/m³ (5000-5800 kJ/m³). Der Luftbedarf zur Verbrennung im Motor ist etwa 1.0 - 1.2. Somit ist der Gemischheizwert ca. 600-650 kcal/m³ (2500-2700 kJ/m³). Der Leistungsabfall gegenüber Benzin (ca. 900 kcal/m³) beträgt daher 28-35%. Ein weiterer Leistungsabfall kann sich durch den geringeren Füllungsgrad des Motors ergeben (Strömungswiderstand im Generator) sowie durch die langsame Verbrennung des Generatorgases im Vergleich zu Benzingas.
Als Gegenmassnahme wurden die Motoren höher verdichtet oder aufgeladen, ausserdem erfolgte die Zündung 10-15° früher, meist manuell nach Gefühl. Zudem verfügten die meisten Anlagen über Manometer, sodass bei beginnender Verstopfung der Filter oder des Herdes rechtzeitig reagiert werden konnte. Aufgrund der Eigenheiten von Holzgas ergibt sich der wirtschaftlichste Betrieb mit einem grossvolumigen, langsam laufenden Benzinmotor (siehe Ford Model A mit Holzvergaser).
1 Liter Benzin entspricht:
- ca. 2.5 - 3.0 kg Hartholz
- ca. 3.0 - 3.5 kg Torf (Vorstadium von fossiler Kohle)
- ca. 1.5 - 2.0 kg Braunkohle (auch bekannt als Unionbriketts)
Quelle: https://holzgas.ch/funktion.shtml
Videobeiträge
Holzgasschulung |
Holzgasfahrzeuge / WW2 | |
Ein gutes Buch zum Thema: Synthese- Holz- und Kohlegas Datei:Kleine Holzvergaser.pdf Quelle: http://www.imtreibhaus.de/moodle/file.php/1/HV_Druck.pdf